Spreminjanje DNK
Če se na hitro ozrete po pisarni Anthonyja Jamesa, ni težko uganiti, s čim si služi kruh. Stene so prekrite s skicami komarjev. Police se šibijo pod težo knjig o teh žuželkah.Ob mizi visi plakat s podobami, ki prikazujejo vse stopnje razvoja vrste komarjev Aedes aegyp-ti – od jajčeca do bube in odrasle živali, vse pa je povečano na velikost, ki bi pretresla celo najbolj gorečega oboževalca filma Jurski park. Na znanstvenikovihregistrskih tablicah preberemo eno samo besedo: AEDES. “S komarji sem obseden že 30 let,” pravi James, molekularni genetik s Kalifornijske univerze v Irvinu. Čeprav je na svetu okoli 3500 različnih vrst komarjev, se ukvarja samo z najsmrtonosnejšimi. Med njimi je tudi Anopheles gambiae, prenašalec povzročitelja malarije, ki vsako leto pokonča več sto tisoč ljudi. Kljub vsemu je James na svoji poklicni poti dobršen del časa posvetil aedesu. Zgodovinarji so prepričani, da je ta vrsta komarja prišla v novi svet skupaj s sužnji iz Afrike v 17. stoletju in s sabo prinesla rumeno mrzlico, ki je pomorila na milijone ljudi.
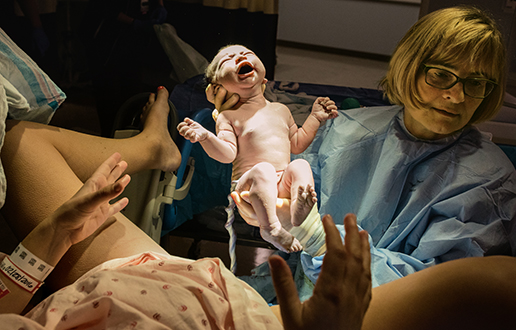 Calla Vanderberg je prišla na svet v porodnišnici Inova v Falls Churchu v Virginiji. V tej bolnišnici vsem novorojencem pregledajo sedem genov, ki so vpleteni v presnovo zdravil, zato bodo zdravniki v prihodnosti lahko zdravljenje prilagodili njenim edinstvenim genskim značilnostim.
Calla Vanderberg je prišla na svet v porodnišnici Inova v Falls Churchu v Virginiji. V tej bolnišnici vsem novorojencem pregledajo sedem genov, ki so vpleteni v presnovo zdravil, zato bodo zdravniki v prihodnosti lahko zdravljenje prilagodili njenim edinstvenim genskim značilnostim.
V sodobnem času ista vrsta komarja prenaša dengo – z njo se vsako leto okuži 400 milijonov ljudi – pa tudi čedalje bolj grozeče, pred kratkim odkrite povzročitelje, kot so čikungunja, virus Zahodnega Nila in zika. Lani je v Braziliji izbruhnila zika, ki jo povezujejo z različnimi nevrološkimi motnjami in mikrocefalijo, to pomeni, da se otroci okuženih mater rojevajo z nenormalno majhno glavo in manj razvitimi možgani. Izbruh se širi. V Jamesovem laboratoriju si prizadevajo najti način, kako preurediti gene komarjev tako, da bi jih onesposobili za prenašanje bolezni. Do pred kratkim se je ta zamisel zdela bolj teoretične narave, vendar je zaradi postopkov združevanja nove tehnologije CRISPR-Cas9 in naravnega dogajanja, znanega kot genska težnja ali “gene drive”, zdaj postala oprijemljivejša. Tehnologija CRISPR daje človeku moč, kakršne še ni imel. Znanstvenikom je prvič omogočila hitro in natančno spreminjanje, brisanje in preurejanje DNK tako rekoč vsakega živega bitja, tudi človeka. V biologiji ima ta tehnologija zadnja tri leta velikanski vpliv, saj so v laboratorijih po vsem svetu z njo na živalskih modelih že dokazali, da je mogoče popraviti tudi večje genske napake – med njimi mutacije, odgovorne za mišično distrofijo, cistično fibrozo in enega od hepatitisov. Nekaj raziskovalnih skupin je uporabilo CRISPR celo v poskusih odstranjevanja virusa HIV iz človeške DNK. Čeprav so za zdaj takšni poskusi le delno uspešni, je veliko znanstvenikov prepričanih, da bo v prihodnosti ta tehnologija morda pripomogla k odkritju zdravila za aids.
 Kliknite na sliko za povečavo.
Kliknite na sliko za povečavo.
V poskusnem okolju se je izkazala za uporabno tudi pri odstranjevanju virusne DNK iz prašičjega genetskega materiala, to pa je pomembno za potrebe presajanja prašičjih organov ljudem. Naravovarstveniki bi radi s to tehnologijo zavarovali ogrožene vrste, za rastlinstvo specializirani biologi pa želijo iz poljščin izbrisali gene, zaradi katerih so te privlačne za škodljivce. Tako bi se izognili uporabi kemičnih sredstev in zmanjšali odvisnost od zdravju škodljivih pesticidov. Nobeno znanstveno odkritje v prejšnjem stoletju ni toliko obetalo – in hkrati porajalo toliko etičnih vprašanj. Tema večine polemik je možnost uporabe tehnologije CRISPR na človeških zarodnih celicah, torej celicah z dednim genskim materialom. S preurejanjem tega materiala bi znanstveniki sicer lahko popravili posamezne genetske pomanjkljivosti ali okrepili želeno lastnost, vendar bi se spremembe nemara prenašale na posameznikove otroke, na otroke teh otrok in tako naprej v neskončnost. Tako rekoč nemogoče je predvideti vse morebitne posledice takšnih sprememb. “Ta tehnologija je resnično neverjetna in nekatere možnosti uporabe so navdušujoče. Vendar je treba imeti za tako usodno početje, kot je gensko preoblikovanje zarodnih celic, zelo dobre razloge,” je povedal direktor Broadovega inštituta Eric Lander, ki je vodil tudi projekt razvozlavanja človeškega genoma. “Pri vsem skupaj je nujno družbeno soglasje – če širša javnost ne bo soglašala, dela ne bomo nadaljevali.”
 Veterinar Long Haibin na hodniku Farmacevtskega raziskovalnega inštituta v Kantonu pozira s Taingoujem, enim od dveh psov pasme beagle. Vzredili so ju iz zarodkov, spremenjenih tako, da imajo živali dvojno mišično maso. Taki poskusi bodo morda v prihodnosti pomembni za razumevanje mišične distrofije in drugih človeških bolezni.
Veterinar Long Haibin na hodniku Farmacevtskega raziskovalnega inštituta v Kantonu pozira s Taingoujem, enim od dveh psov pasme beagle. Vzredili so ju iz zarodkov, spremenjenih tako, da imajo živali dvojno mišično maso. Taki poskusi bodo morda v prihodnosti pomembni za razumevanje mišične distrofije in drugih človeških bolezni.
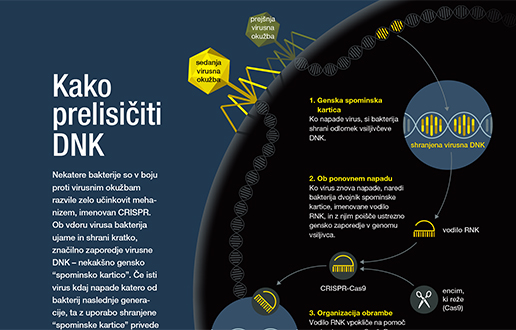
“Znanstveniki niso pravi naslov za ta vprašanja,” je dejal Lander. “V resnici niti ne vem, kdo naj bi sploh bil.” CRISPR-Cas9 sestavljata dva dela. Prvi je encim Cas9, ki učinkuje kot celični skalpel in prereže DNK. (V naravi ga bakterije uporabljajo, da poškodujejo in onesposobijo genski zapis virusov, vdirajočih v telo.) Drugi je vodilo RNK, ki ta skalpel vodi k izbranim nukleotidom – kemičnim črkam DNK, določenim za preurejanje. (Raziskovalci v pogovorih redko uporabljajo izraz “Cas9” ali razvezano kratico CRISPR, ki pomeni “clustered regularly interspaced short palindromic repeats”, po slovensko skupki enakomerno prekinjenih kratkih palindromnih ponovitev.) Natančnost vodila je brez primere; znanstveniki lahko pošljejo umetni nadomestni del na katerokoli mesto v genomu, ki obsega milijarde nukleotidov. Ko encim Cas9 doseže cilj, izreže neželeno zaporedje DNK, nastalo vrzel pa celica zapolni z verigo nukleotidov iz dostavljenih skupkov enakomerno prekinjenih kratkih palindromnih ponovitev. Glede na znane podatke o drugih boleznih, ki jih prenašajo komarji, v ameriškem Središču za nadzor in preprečevanje bolezni (CDC) menijo, da bo do takrat, ko se bo izbruh v Portoriku unesel, z ziko na tem ozemlju predvidoma okužena že vsaj četrtina od 3,5 milijona prebivalcev. To pomeni, da bo med okuženimi zelo verjetno tudi več tisoč nosečnic. Za zdaj bi edini resnično učinkovit ukrep proti ziki moral vključevati “čiščenje” otoka z insekticidom. James in drugi pa so prepričani, da je (trajno) spreminjanje genskega materiala komarjev s tehnologijo CRISPR boljša rešitev.
Video.
